-
INTRODUCCIÓN AL SISTEMA INMUNE HUMANOIntroducción. Conceptos básicos10 Temas
-
Introducción Inmunología
-
Funciones sistema inmune y barreras de defensa
-
Inmunidad innata vs adaptativa
-
Respuesta humoral vs celular
-
Respuesta adaptativa primaria vs secundaria
-
Características de la respuesta inmunitaria adaptativa
-
Concepto de antígeno
-
La respuesta inmunitaria específica es clonal
-
Revisión de los componentes del sistema inmunitario
-
Patología general del sistema inmunitario
-
Introducción Inmunología
-
Células del sistema inmune y diferenciación celular6 Temas
-
Hematopoyesis
-
Las células sanguíneas (I): Granulocitos y Mastocitos
-
Las células sanguíneas (II): Plaquetas, Eritrocitos, Monocitos y Macrófagos
-
Las células sanguíneas (III): Linfocitos (T y B), Células plasmáticas y LGL (Linfocitos NK)
-
Las células sanguíneas (IV): Células dendríticas y proporciones relativas de los tipos celulares
-
Funciones y gestión de receptores para antígenos
-
Hematopoyesis
-
Tejidos del sistema inmune: órganos linfoides 1º y 2º3 Temas
-
Células y mecanismos de la inmunidad innata (I): macrófagos, receptores y mecanismos efectores5 Temas
-
Células y mecanismos de la inmunidad innata (II): linfocitos NK, receptores y mecanismos efectores4 Temas
-
MOLÉCULAS IMPLICADAS EN EL RECONOCIMIENTO DE ANTÍGENOEl receptor de antígeno del linfocito B6 Temas
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
Inmunoglobulinas (II): Clases, formas, variabilidad y tejidos
-
Inmunoglobulinas (III): Enlaces antígeno-anticuerpo y funciones
-
Inmunoglobulinas (IV): Receptores para inmunoglobulinas
-
Inmunoglobulinas (V): Procesamiento de RNA, receptor del linfocito B, complejo co-receptor y activación célula B
-
Inmunoglobulinas (VI): Desarrollo / Diferenciación células B
-
Inmunoglobulinas (I): Formas en la naturaleza, estructura y dominio básico
-
El receptor de antígeno del linfocito T4 Temas
-
Mecanismos de generación de la diversidad de linfocitos T y B9 Temas
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
Reordenamiento de los genes
-
Mecanismos de amplificación de la diversidad
-
Expresión de las inmunoglobulinas en el BCR
-
Maduración de los linfocitos B
-
La cooperación T-B
-
Anomalías/Problemas en el proceso (CLÍNICA)
-
Maduración de los linfocitos B
-
Variabilidad en el repertorio del TcR en linfocitos T
-
Genes para las cadenas pesadas y ligeras: Diversidad potencial
-
El complejo principal de histocompatibilidad (I): estructura proteica, genética y nomenclatura3 Temas
-
El complejo principal de histocompatibilidad (II): Procesamiento y presentación de antígeno, polimorfismo y aplicaciones clínicas5 Temas
-
MOLÉCULAS ACCESORIAS DE LA RESPUESTA INMUNEEl sistema del complemento y sus receptores (I): vía clásica y vía alternativa4 Temas
-
El sistema del complemento y sus receptores (II): vía de las lectinas, vía lítica y regulación3 Temas
-
Moléculas implicadas en la comunicación intercelular (I): citocinas y sus receptores5 Temas
-
Moléculas implicadas en la comunicación intercelular (II): moléculas de adhesión y sus ligandos3 Temas
-
EL SISTEMA INMUNE EN ACCIÓN BLOQUEGeneración de linfocitos T efectores4 Temas
-
Generación de linfocitos B efectores7 Temas
-
Sistema Inmune asociado a mucosas (MALT)9 Temas
-
Introducción MALT
-
Estructura del tejido linfoide asociado a la mucosa intestinal
-
Recirculación y migración selectiva de linfocitos al intestino
-
Barrera epitelial intestinal: Función Inmunológica
-
Receptores para el reconocimiento de patrones moleculares
-
Inmunoglobulinas Poliméricas: IgM + IgA
-
Vías de entrada del antígeno en el intestino
-
Diferenciación de los linfocitos T efectores MALT
-
Tolerancia Oral ante antígenos solubles
-
Introducción MALT
-
La respuesta inmune (I): inmunidad innata e inflamación aguda8 Temas
-
Barreras no específicas frente a infección por microorganismos patógenos
-
Principales leucocitos que paticipan en las inmunidad innata
-
La rección inflamatoria
-
Inflamación aguda
-
Sucesos del proceso inflamatorio
-
Citocinas producidas por macrófagos: efectos locales y sistémicos
-
Efectos de las citocinas en la inmunidad innata
-
Proteínas de fase aguda
-
Barreras no específicas frente a infección por microorganismos patógenos
-
La respuesta inmune (II): mecanismos de la inmunidad específica8 Temas
-
La respuesta inmune (III): respuesta frente a virus, bacterias y hongos, protozoos y helmintos9 Temas
-
Principales enfermedades infecciosas mortales
-
Patógenos infecciosos
-
Respuestas frente a bacterias extracelulares
-
Respuesta frente a bacterias intracelulares
-
Proceso de fagocitosis
-
Respuestas frente a protozoos y helmintos
-
Ciclo vital del plasmodium
-
Respuestas inmunitarias frente a virus
-
Mecanismos de evasión inmunitaria. Virales y bacterianos.
-
Principales enfermedades infecciosas mortales
-
REGULACIÓN e INTRODUCCIÓN A LA INMUNOPATOLOGÍARegulación de la respuesta inmune (I): regulación por moléculas8 Temas
-
Regulación de la respuesta inmune: Introducción
-
Regulación por moléculas: el complemento (I)
-
Proteínas reguladoras del complemento y proceso de regulación (II)
-
Proceso de regulación por complemento (III)
-
Regulación de los anticuerpos preformados
-
Regulación por anticuerpos: Redes idiotípicas
-
Regulación por moléculas de linfocitos T
-
Regulación a nivel bioquímico: ITAM frente a ITIM
-
Regulación de la respuesta inmune: Introducción
-
Regulación de la respuesta inmune (II): regulación por células y sistemas4 Temas
-
El sistema inmune a lo largo del ciclo vital: Inmunosenescencia6 Temas
-
Introducción a la inmunopatología13 Temas
-
Conceptos básicos
-
Inmunodeficiencias
-
Las Inmunodeficiencias (II): Déficits de Complemento
-
Las Inmunodeficiencias (III): Déficits de citocinas en receptores
-
Las Inmunodeficiencias (IV): Déficits de TLR's
-
Las Inmunodeficiencias (V): Déficits de función fagocitaria
-
Las Inmunodeficiencias (VI): Déficit de linfocitos B
-
Las Inmunodeficiencias (VII): Déficits de linfocitos T
-
Inmunodeficiencias primarias (IDP's): Clínica y Diagnóstico
-
Hipersensibilidades
-
Autoinmunidad
-
Trasplantes. Rechazo
-
Inmunidad frente a tumores
-
Conceptos básicos
-
Introducción a la Inmunoterapia8 Temas
-
Vacunas (I): Bases inmunológicas
-
Vacunas (II): Tipos de vacunas
-
Inmunoterapia frente a enfermedades autoinmunes
-
Anticuerpos monoclonales en la terapia del cáncer
-
Otras estrategias anti-tumorales
-
Tratamiento “clásico” de la patología alérgica
-
Inmunoterapia en el trasplante de órganos
-
Tratamiento de inmunodeficiencias primarias
-
Vacunas (I): Bases inmunológicas
Linfocitos T: Receptor para antígeno
Aquí tienes el temario explicado en el vídeo anterior. Si tienes alguna duda plantéala en el sistema de comentarios del final de la página.
Estructura proteica del tcr
El receptor de la célula T (TcR) consta de una colección de proteínas de membrana, unas involucradas en el reconocimiento del antígeno (proteínas variables) y otras con función estructural o de transmisión de señal al interior celular (proteínas constantes).
Proteínas variables
Como ya se ha descrito, existen dos posibles receptores de la célula T en cuanto a la composición de las cadenas variables, α-β (células T2) y γ-δ (células T1).
Estructura del receptor de la célula T α-β
El receptor antigénico mayoritario tanto de las células T cooperadoras (CD4+) como de los linfocitos T citotóxicos (CD8+) es un heterodímero formado por dos cadenas polipeptídicas transmembrana denominadas α y β, unidas entre sí de forma covalente mediante un puente disulfuro (Figura 7.2). Esta estructura heterodimérica es “equivalente” a un fragmento FaB de la inmunoglobulina. Cada cadena consta de dos dominios: un dominio variable (V) N-terminal que reconoce los antígenos y un dominio constante (C) que interviene en la señalización. Por lo tanto, el TcR es otro miembro de la superfamilia de las inmunoglobulinas.
Las regiones V de las cadenas α y β poseen tramos cortos de secuencias en los que se concentra la variabilidad entre los diferentes TcR y que forman las regiones hipervariables o determinantes de complementariedad (CDR). En la cadena α encontramos 3 CDR yuxtapuestos a los CDR de la cadena β formando parte del TcR que reconoce la molécula MHC.
A continuación de los dominios C está la región bisagra, corta y con residuos de cisteína que contribuyen a un puente disulfuro entre ambas cadenas. Posteriormente está la zona transmembrana hidrófoba y finalmente las cadenas α y β, que poseen colas citoplasmáticas carboxiterminales cortas.
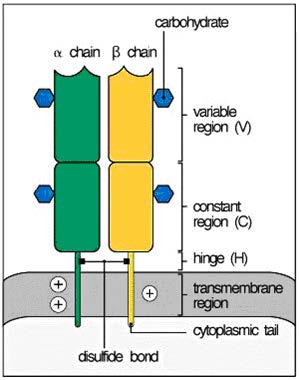
(Reproducido de Murphy K et al. (2008) Janeway’s Immunobiology (7th Ed.) Garland Science, Nueva York.)
Estructura del receptor de la célula T γ−δ
Es un segundo tipo de heterodímero unido por un puente disulfuro que se expresa en una pequeña subpoblación de células T, que constituyen menos del 5% de todas las células T (en sangre periférica, aunque pueden estar en mayor proporción en tejidos linfoides secundarios, principalmente mucosos). Consta de regiones V y C extracelulares de tipo inmunoglobulina, una región bisagra, segmentos transmembrana hidrófobos y colas citoplasmáticas cortas similares a las de las cadenas α-β. La región bisagra contiene residuos de cisteína implicados en puentes disulfuro intercatenarios. La función de este tipo de receptor aún no está clara, pero es menos evolucionado y se sabe que reconoce moléculas no peptídicas derivadas de bacterias además de moléculas fosforiladas pequeñas (fosfolípidos presentados por CD1).
Los linfocitos con receptores α-β pueden expresar el correceptor CD4 (Th), o el CD8 (Tc), pero nunca ambos simultáneamente. Los linfocitos T con receptor γ-δ normalmente no expresan correceptor y, si lo hacen, será siempre CD8.
Proteínas constantes
Las proteínas CD3 y el dímero δ-δ se asocian de forma no covalente a los heterodímeros α-β ó γ-δ, y cuando el TCR reconoce el antígeno, estas proteínas asociadas transducen las señales que dan lugar a la activación de la célula T.
Proteínas CD3
El complejo proteico CD3 está compuesto por 3 tipos de proteínas: CD3-γ, CD3-δ y CD3-ε. Estas 3 proteínas se organizan formando dos heterodímeros junto al TCR: CD3-ε/CD3-γ y CD3- ε/CD3-δ (Figura 7.3). Los genes de estas tres proteínas se localizan contiguos en el cromosoma 11, por lo que se propone un origen evolutivo común. Las regiones extracelulares N-terminales de las cadenas CD3-γ, -δ y -ε contienen un dominio único de tipo inmunoglobulina, y por ello las tres forman parte de la superfamilia de las inmunoglobulinas. Los dominios citoplasmáticos de CD3-γ, -δ y -ε contienen motivos con funciones de señalización denominados ITAM (motivos de tirosinas de activación de inmunorreceptores).
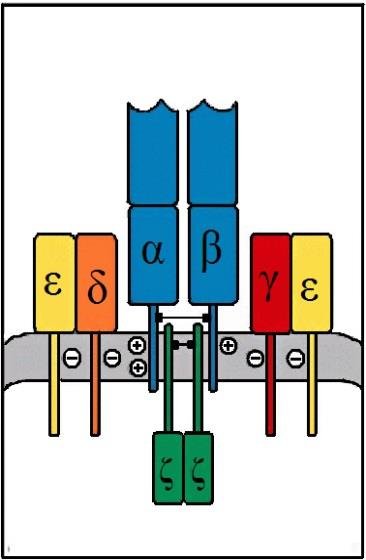
(Reproducido de Murphy K et al. (2008) Janeway’s Immunobiology (7th Ed.) Garland Science, Nueva York.)
Dímero δ-δ
Los complejos TCR también contienen un homodímero de la cadena δ unido por un puente di- sulfuro. Esta cadena δ, aunque es también transmembranal, tiene la mayor proporción de la proteína en el citoplasma celular. Las proteínas CD3 y la cadena δ son idénticas en todas las células T con independencia de su especificidad, lo que confirma que intervienen en la señalización y no en el reconocimiento del antígeno.
La cadena δ tiene una región extracelular corta, una región transmembrana y una región cito- plasmática larga que contiene tres ITAM. Esta cadena pertenece a la superfamilia de las inmunoglobulinas.

Responses